Adenozin-monofoszfát egy olyan nukleotid, amely az energiahordozó adenozin-trifoszfát (ATP) részét képezheti. Ciklikus adenozin-monofoszfátként második messengerként is szolgál. Ez többek között az ATP lebontásakor jön létre, amely energiát bocsát ki.
Mi az adenozin-monofoszfát?
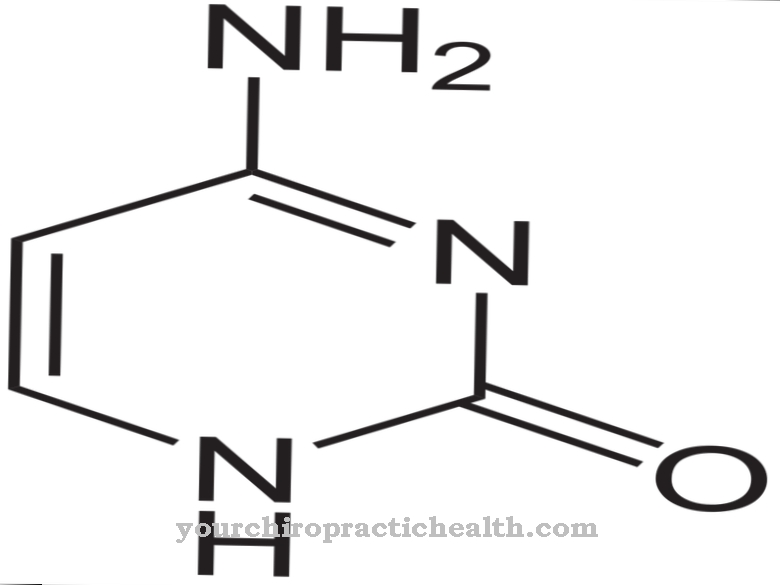
Az adenozin-monofoszfát (C10H14N5O7P) nukleotid és a purin ribotidokhoz tartozik. A purin egy építőanyag az emberi testben, amely minden más élőlényben megtalálható. A molekula kettős gyűrűt képez, és soha nem jelenik meg önmagában: A purint mindig összekapcsolják más molekulákkal nagyobb egységek kialakítása céljából.
A purin az adenin egyik építőköve. Ez a bázis megtalálható a dezoxiribonukleinsavban (DNS) is, és genetikailag tárolt információkat kódol. Az adenin mellett a guanin a purinbázisokhoz is tartozik. Az adenozin-monofoszfátban lévő adenin két másik építőelemhez kapcsolódik: ribózhoz és foszforsavhoz. A Ribose C5H10O5 molekularészű cukor. A biológia a molekulát pentóznak is nevezi, mert öttagú gyűrűből áll. Az adenozin-monofoszfátban a foszforsav kötődik a ribóz ötödik szénatomjához. Az adenozin-monofoszfát további elnevezései az adenilát és az adenilsav.
Funkció, hatás és feladatok
Ciklikus adenozin-monofoszfát (cAMP) támogatja a hormonális jelek továbbítását. Például egy szteroid hormon kötődik egy receptorhoz, amely a sejtmembrán külső oldalán található. Bizonyos értelemben a receptor a sejt első vevője. A hormon és a receptor illeszkedik egymáshoz, mint egy kulcs és retesz, így biokémiai reakciót vált ki a sejtben.
Ebben az esetben a hormon az első hírvivő, amely aktiválja az adenilát-cikláz enzimet. Ez a biokatalizátor az ATP-t hasítja a sejtben, cAMP-ként jön létre. Ezután a cAMP egy másik enzimet aktivál, amely a sejt típusától függően kiváltja a sejt választ - például egy új hormon előállítása. Az adenozin-monofoszfát a második szignál anyagának vagy egy második hírvivőnek a funkcióját látja el.
A molekulák száma azonban nem változik lépésről lépésre: A molekulák száma körülbelül tízszeresére nő reakciólépésenként, ami növeli a sejt válaszát. Ez is az oka annak, hogy a hormonok nagyon alacsony koncentrációban elegendőek az erős reakció kiváltásához. A reakció végén a cAMP maradványai az adenozin-monofoszfát, mely más enzimek visszatérhetnek a ciklushoz.
Amikor egy enzim az AMP-t hasítja az adenozin-trifoszfátból (ATP), energia keletkezik. Az emberi test különböző módon használja ezt az energiát. Az ATP a legfontosabb energiahordozó az élőlényekben, és biztosítja, hogy biokémiai folyamatok zajlanak mikro szinten, valamint az izmok mozgásai.
Az adenozin-monofoszfát szintén a ribonukleinsav (RNS) egyik építőköve. Az emberi sejtek magjában a genetikai információkat DNS formájában tárolják. Annak érdekében, hogy a sejt vele dolgozzon, lemásolja a DNS-t és létrehoz egy RNS-t. A DNS és az RNS ugyanazon információt tartalmaz ugyanazon szakaszon, de molekuláik szerkezetében különböznek.
Oktatás, előfordulás, tulajdonságok és optimális értékek
Az adenozin-monofoszfát az adenozin-trifoszfátból (ATP) származhat. Az adenilát-cikláz enzim hasítja az ATP-t és energiát enged fel a folyamatban. Az anyagok foszforsavja különösen fontos szerepet játszik. A foszfoanhidrit kötődik az egyes molekulákhoz. A hasításnak számos lehetséges következménye lehet: vagy enzimek osztják az ATP-t adenozin-difoszfátra (ADP) és ortofoszfátra, vagy AMP-re és pirofoszfátra. Mivel az energia anyagcseréje alapvetően egy ciklus, az enzimek az egyes építőelemeket is visszavehetik az ATP-be.
A mitokondriumok felelősek az ATP szintéziséért. A mitokondriumok olyan sejtes organellák, amelyek a sejtek erőműveiként működnek. A sejt többi részétől saját membránjuk választja el őket. A mitokondriumokat az anya (anyai) örökölte. Az adenozin-monofoszfát minden sejtben előfordul, ezért az emberi testben mindenütt megtalálható.
Betegségek és rendellenességek
Az adenozin-monofoszfáttal számos probléma merülhet fel. Például zavarhatja az ATP szintézisét a mitokondriumokban. Az orvostudomány ezt a diszfunkciós mitokondriális betegséget is nevezi. Ennek különféle okai lehetnek, beleértve a stresszt, a rossz étrendet, a mérgezést, a szabad gyökök károsodását, a krónikus gyulladást, a fertőzést és a bélbetegségeket.
A szindróma kialakulásáért gyakran a genetikai rendellenességek felelősek. A mutációk megváltoztatják a genetikai kódot, és különféle rendellenességekhez vezetnek az energia-anyagcserében vagy a molekulák szerkezetében. Ezek a mutációk nem feltétlenül találhatók meg a sejtmag DNS-ében; A mitokondriumoknak megvan a saját genetikai felépítése, amely a sejtmag-DNS-től függetlenül létezik.
A mitokondriopathiában a mitokondriumok csak lassabban termelnek ATP-t; a sejteknek ezért kevesebb energiája van. A teljes ATP felépítése helyett a mitokondriumok több ADP-t szintetizálnak, mint a normál. A sejtek ADP-t is felhasználhatnak energia előállításához, de az ADP kevesebb energiát bocsát ki, mint az ATP. A mitokondriális betegségben a test energiafelhasználóként használhatja a glükózt; lebontásuk során tejsav képződik. A mitokondriális betegség nem önmagában betegség, hanem olyan szindróma, amely a betegség részét képezheti.
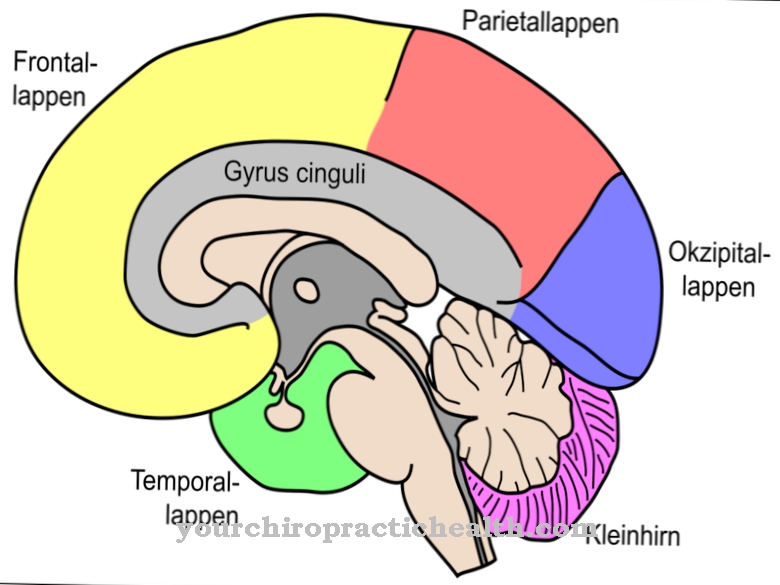
Az orvostudomány összefoglalja a mitokondriális rendellenességek különféle megnyilvánulásait. Ez előfordulhat például a MELAS szindróma összefüggésében. Ez egy neurológiai betegség, amelyet rohamok, agykárosodás és fokozott tejsavképződés jellemez. Ezenkívül a mitokondriális betegség a demencia különféle formáival is összefügg.


.jpg)











.jpg)