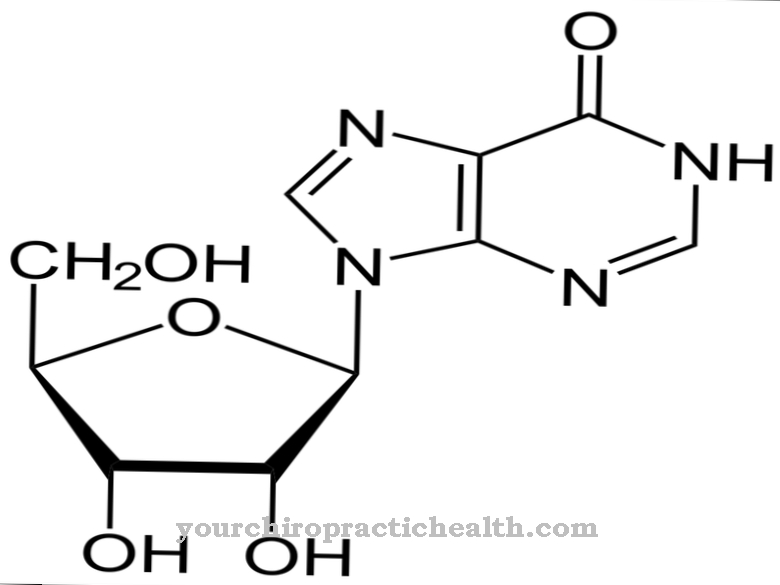
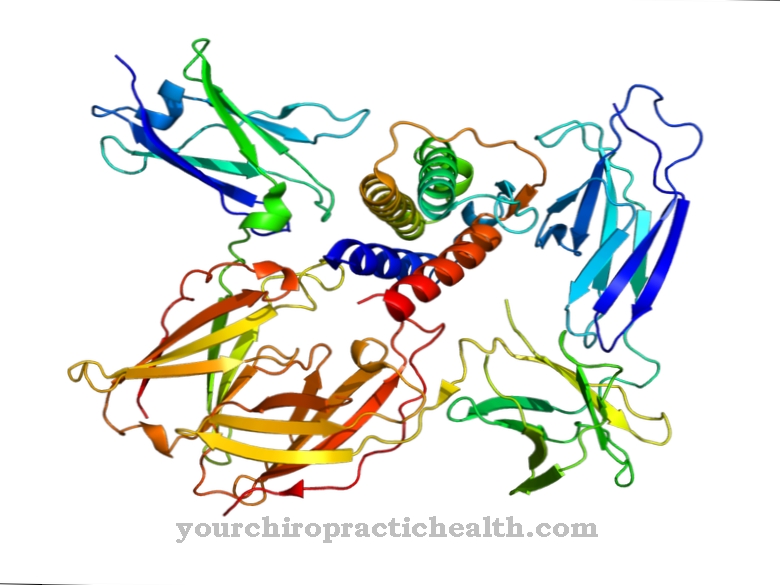
hidroxi egy nem-klasszikus proteinogenikus aminosav. Ezt beépítik a megfelelő fehérjébe lizin formájában és hidrolizálják hidroxilizinné a polipeptidben egy enzim segítségével. Ez a kötőszövetben lévő kollagénfehérjék egyik fő alkotóeleme.
Mi az a hidroxilizin?
A hidroxilizin egy proteinogenikus aminosav, amelyet először lizinként épít be a fehérjébe. Ezért ez egy nem-kanonikus proteinogén aminosav. A "kanonikus" kifejezés klasszikusat jelent.
Tehát ennek az aminosavnak nincs kodonja. A hidroxilizint elsősorban a kötőszöveti kollagénben és a glikoproteinekben találják. Ott a lizint enzimatikus folyamatokkal hidroxilizinné alakítják. A lizinnek csak egy része átalakul hidroxilizinré. A megfelelő kollagének tulajdonságai a hidrolizált lizin- és prolinmaradékok mennyiségétől függnek.
A hidroxilizin szabad formában, hidroklorid formájában izolálható. A hidroxilizin-hidroklorid bézs színű por, amelynek olvadáspontja 225–230 ° C. Ez egy bázikus aminosav, amely szintén megkönnyíti a hidroxilizin-tartalmú proteinek bázikus reakcióját. A hidroxilizint az amerikai biokémikus és a "Klinikai Kémia" társalapítója, Donald Van Slyke (1883-1971) fedezte fel.
Funkció, hatás és feladatok
A hidroxilizinnek nagy jelentősége van a kötőszövet szerkezetében. A glikoproteinek hidroxilizint is tartalmaznak annak érdekében, hogy a fehérje glikozidvegyületeit cukormaradékokkal képezzék a hidroxilcsoporton.
A kollagénben felelős az egyes fehérjemolekulák térhálósodásáért. A prolin hidrolizált formájával együtt a hidroxilprolinnal együtt járul hozzá a kollagén tercier és kvaterner struktúrájának kialakításához is. A lizin hidroxilálását a lizil-hidroxiláz enzim katalizálja, a kofaktorok vasionok és aszkorbinsav (C-vitamin) részvételével. A kollagénben a hidroxilált lizinmaradékok megoszlási mintája nem különösebben merev és rugalmas. Mindig ismétlődő minták vannak.
A fehérjében vannak azonban olyan teljes területek is, amelyek nem tartalmaznak hidroxilált lizin maradványokat. Míg a hidroxi-prolin felelős a kollagén spirális szerkezetéért három fehérjelánc kötésén keresztül, a különféle fehérjemolekulák között keresztkötések keletkeznek a hidroxilizin hidroxilcsoportjain keresztül. Ezenkívül ezek a molekuláris csoportok egy kötőhelyként is szolgálnak a cukorral való glikozidos kötéshez. Összességében ez biztosítja a kötőszövet szilárdságát.
Ha a fehérjékben hiányzik a hidroxilizin, akkor ezt az aminosav további bevitelével nem lehet orvosolni. Nincs szabad kodon a szabad hidroxilizin számára, így azt nem lehet beépíteni a megfelelő fehérjébe. Ezért nagyon megkérdőjelezhető az étrend-kiegészítők értéke hozzáadott hidroxilizinnel. Ezért a hiánynak a lizin nem megfelelő hidroxilezésének kell lennie.
Oktatás, előfordulás, tulajdonságok és optimális értékek
A hidroxilizin csak az emberi és állati kollagénben található meg. Vannak olyan glikoproteinek is, amelyek hidroxilizint is tartalmaznak. Ide tartozik az adiponektin. Az adiponektin egy olyan hormon, amelyet a zsírszövet termeszt, és amely döntően befolyásolja az inzulin hatékonyságát. Néhány baktériumban, például a Staphylococcus aureus-ban a hidroxilizint is kimutatták.
A hidroxilált lizin eloszlása a kollagénben nem egyenletes. Vannak olyan helyek, ahol szinte mindig megtalálják. Más területeken a hidroxilizint szinte soha nem találták meg. Ez az egyenetlen eloszlás határozza meg a kollagén szerkezetét. A kollagén hármas spirálszerkezetén belül a hidroxilizin mindig a Gly-X-Y ismétlődő szekvencia Y helyzetében található. A nem spirális szerkezetű rövid régiókban a hidroxilizin más helyeken is előfordul.
Betegségek és rendellenességek
A kötőszövet teljesen függ a hidroxilizin jelenlététől. A kollagén csak akkor lehet stabil és szilárd, ha a fehérjemolekulák közötti keresztkötések működnek. A hidroxilizin hiánya a kötőszövet gyengeségét okozza.
Ha csak rendkívül kis mennyiségben van jelen, vagy egyáltalán nincs, akkor a megfelelő szervezet nem életképes. A kötőszövet már nem tudta elvégezni feladatát, mint a szervek korlátozó és támogató szövetét. Valójában vannak olyan betegségek, amelyek a hidroxilizin hiányára vezethetők vissza. Mivel ez az aminosav kezdetben lizinként van beépítve a fehérje szintézisbe, ez nem lehet elsődleges hiány. A hidroxilizin lizinből képződik a kollagénfehérjében lizil-hidroxilázok segítségével. A hidroxilizin-hiány csak ennek az enzimnek a hibája vagy elégtelen működése miatt vezethető be.
Van egy heterogén veleszületett kötőszöveti gyengeség egy csoportja, amelyet Ehlers-Danlos szindrómának neveznek. Számos mutáció felelős e klinikai képért. Többek között a lizil-hidroxiláz is hibás lehet, így túl kevés lizin hidroxilálódik. Az Ehlers-Danlos szindróma a bőr túlfeszíthetőségén és az ízületek túlmobilitásán keresztül nyilvánul meg. A belső szervek, az erek, az inak, a szalagok és az izmok szintén érintettek. A prognózis a hiba súlyosságától függ. Ha az erek részt vesznek, akkor kedvezőtlen folyam várható. A lizil-hidroxiláz enzim teljes kudarca összeegyeztethetetlen az élettel, ezért nem figyelhető meg.
De még ép enzimnél is lehet gyenge kötőszövet alacsony aktivitása miatt. A lizil-hidroxilázhoz vasionok és aszkorbinsav (C-vitamin) szükségesek kofaktorokként. Például, ha hiányzik C-vitamin, akkor úgy fordul elő a skorbut. A skorbut egy megszerzett kötőszövet-betegség, amelyet a kollagén prolin- és lizinmaradványainál lévő hidroxilcsoportok hiánya okoz. Ennek oka a prolin-hidroxiláz és a lizin-hidroxiláz alacsony aktivitása az aszkorbinsav-hiány miatt.