A miozin a motoros fehérjékhez tartozik, és többek között felelős az izmok összehúzódásában részt vevő folyamatokért. Különböző típusú miozinok léteznek, amelyek mind részt vesznek a sejtes organellák szállítási folyamatában vagy a citoszkeletonon belüli eltolódásokban. A miozin molekuláris szerkezetének szerkezeti eltérései okozhatják az izombetegségeket.
Mi a miozin?
A dynein és a kinezin mellett a miozin az egyik motoros fehérje, amely felelős a sejtmozgás folyamatáért és a sejten belüli szállítási folyamatokért. A másik két motoros fehérjével szemben a miozin csak aktinnal működik. Az aktin viszont az eukarióta sejt citoszkeletonjának része. Ezért felelős a cella szerkezetéért és stabilitásáért.
Ezenkívül az aktin és a miozin és két másik szerkezeti fehérje képezik az izom tényleges összehúzódó szerkezeti egységét. Az izom zsugorodó fehérjék kétharmada miozinok, egyharmada aktin. A miozinok azonban nemcsak az izomsejtekben, hanem az összes többi eukarióta sejtben is jelen vannak. Ez vonatkozik az egysejtű eukariótákra, valamint a növényi és állati sejtekre. A mikrofilamentumok (aktin filamentumok) minden sejtben részt vesznek a citoszkeleton szerkezetében, és a miozinnal együtt a protoplazmatikus áramot szabályozzák.
Anatómia és felépítés
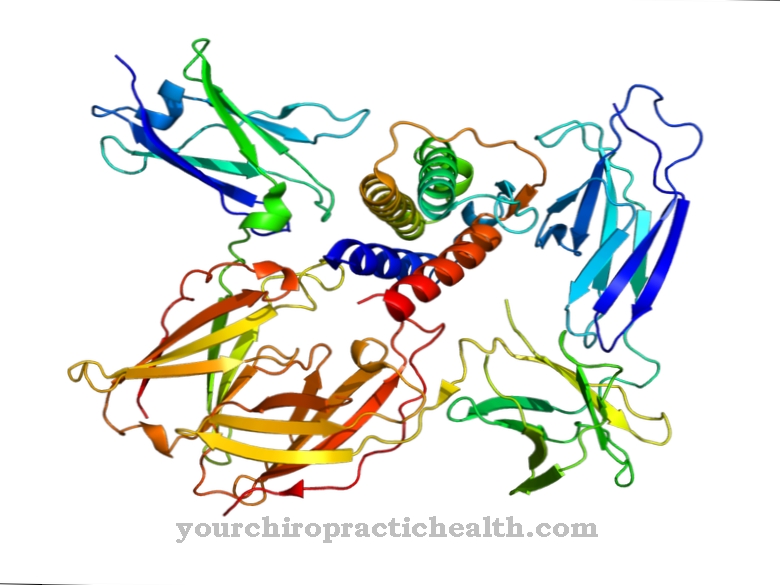
A miozinok különféle osztályokra és alosztályokra oszthatók. Jelenleg több mint 18 különféle osztály ismert, az I., II. És V. osztály a legfontosabb. Az izomrostokban található miozinot hagyományos miozinnek nevezzük és a II. Osztályba tartozik, az összes miozin szerkezete hasonló. Mindegyik egy fejrészből (miozinfej), egy nyaki részből és egy farok részből áll.
A vázizom miozin filamentumai körülbelül 200 miozin II molekulából állnak, mindegyik 500 kDa molekulatömegű. A fejléc genetikailag nagyon konzervatív. A szerkezeti osztályokba sorolást elsősorban a farokrész genetikai variabilitása határozza meg. A fejrész az aktinmolekulához kötődik, míg a nyakrész csuklópántként működik. Több miozin molekula farokrészei felhalmozódnak és filamentumokat (kötegeket) képeznek. A miozin II molekula két nehéz és négy könnyű láncból áll.
A két nehéz lánc úgynevezett dimerből áll. A két lánc közül a hosszabbnak van egy alfa-hélix szerkezete, és 1300 aminosavból áll. A rövidebb lánc 800 aminosavból áll, és az úgynevezett motor domént képviseli, és a molekula fejrészét képezi, amely felelős a mozgásokért és a szállítási folyamatokért. A négy könnyű lánc a nehéz láncok fejéhez és nyakához kapcsolódik. A fejtől távolabb lévő könnyű láncokat szabályozónak nevezzük, a fejhez közeli könnyű láncokat pedig alapvető láncoknak nevezzük. Nagyon ragaszkodnak a kalciumhoz, és így képesek ellenőrizni a nyakrész mobilitását.
Funkció és feladatok
Az összes miozin legfontosabb funkciója az, hogy sejtszerveket szállítson az eukarióta sejtekben és a citoszkeletonon belül eltolódásokat hajtson végre. A hagyományos miozin II molekulák az aktinnal, valamint a tropomyosin és troponin fehérjékkel felelősek az izmok összehúzódásáért. Ehhez a miozint először a titinfehérje segítségével integrálják a szacomer Z-tárcsájába. Hat titinszál rögzíti a miozinszálat.
A sacomerben egy miozin-szál körülbelül 100 keresztkötést képez az oldalakkal. A miozin molekulák szerkezetétől és a mioglobin tartalmától függően az izomrostok több formája megkülönböztethető. Az izmok összehúzódása a szacomerben zajlik a miozin kereszt-híd körüli mozgása miatt. Mindenekelőtt a miozin fej szorosan kapcsolódik az aktin molekulához. Ezután az ATP-t ADP-re osztják, ahol a felszabadult energia a miozinfej feszültségéhez vezet. Ugyanakkor a könnyű láncok biztosítják a kalciumionok növekedését. Ennek következtében a miozin fej konformációs változás eredményeként kapcsolódik a szomszédos aktin molekulához.
A régi csatlakozás elengedésével a feszültséget mechanikai energiává alakítják úgynevezett erőütközés révén. A mozgás hasonló az evezős ecsetvonáshoz. A miozin fej 90 ° -ról 40-50 ° -ra dől. Az eredmény az izommozgás. Az izom összehúzódása során csak a szacomer hossza lerövidül, míg az aktin és a miozin filamentumok hossza változatlan. Az izomzat ATP-ellátása csak körülbelül három másodpercre elegendő. A glükóz és a zsír lebontásával az ADP visszatér az ATP-be, így a kémiai energiát mégis mechanikai energiává lehet alakítani.
betegségek
A miozin mutációk által okozott szerkezeti változásai izombetegségekhez vezethetnek. Egy ilyen betegségre példa a családi hipertróf kardiomiopátia. A családi hipertróf kardiomiopátia egy örökletes betegség, amelyet autoszomális domináns tulajdonságként öröklik. A betegséget a bal kamra megvastagodása jellemzi, tágulás nélkül.
A lakosság 0,2% -os előfordulásával ez egy viszonylag gyakori szívbetegség. Ezt a betegséget mutációk okozzák, amelyek szerkezeti változásokhoz vezetnek a betamyosinban és az alfatropomyosinban. Ez nem egy, hanem több pontmutáció a fehérjékben, amelyek részt vesznek a szacomer szerkezetében. A legtöbb mutáció a 14. kromoszómán található. Kórosan a betegség a bal kamra izmainak megvastagodásaként jelentkezik.
A szívizom vastagságának ezen aszimmetriája szívritmuszavarokhoz vezethet, szívritmuszavarok, légszomj, szédülés, eszméletvesztés és angina pectoris miatt. Noha sok betegnél a szívműködés csak kismértékben vagy egyáltalán nem romlik, progresszív szívelégtelenség alakulhat ki.

.jpg)