Desmosin egy proteinogenikus aminosav. Más aminosavakkal együtt képezi a rost- és a strukturális protein elasztint. Az ELN gén mutációival az elasztin szerkezete zavart.
Mi a desmosin?
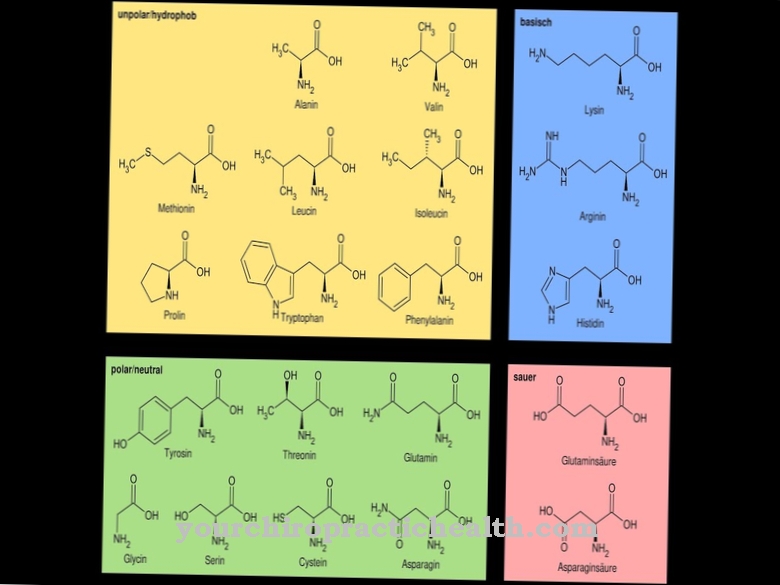
Az aminosavak az emberi szervezet fontos részét képezik. Ezek egy olyan szerves vegyület osztály, amely legalább egy karboxilcsoportból és egy aminocsoportból áll. Az aminosavak tehát karbonsavak és aminok egyaránt.
Az aminosavakat a karboxilcsoporthoz viszonyított helyzetüktől függően különböző csoportokba lehet sorolni. A terminális karboxilcsoportot tartalmazó aminosavakat geminálnak vagy α-nak nevezzük, és az α-aminosavak közé soroljuk. Ezek az aminosavak a fehérjék elemei. Az emberi test több mint 20 proteinogenikus aminosavat és 400 nem proteinogenikus aminosavat tartalmaz. A D-aminosavak egy speciális csoport. A több mint 20 proteinogenikus aminosav közül az egyik a deszmosin, amely az hasonló módon épített izo-dezmozzinnal együtt képezi az elasztin rostfehérjét.
Az elasztin és oldható prekurzor-tropoelastin a szerkezeti fehérjékhez tartozik, és hozzájárul az anatómiai struktúrák kialakulásához és megtartásához. Az elasztin különleges szerepet játszik a nagy erek nyújtó képességében, például az aortában.
Funkció, hatás és feladatok
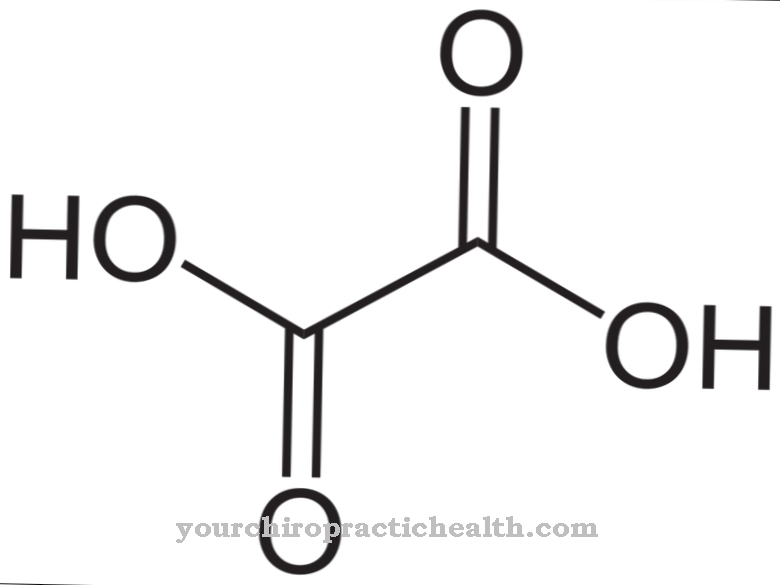
A dezmosin formálisan négyszeres aminosav. Középen piridinium gyűrű található. A piridin egy kémiai vegyület, amelynek empirikus képlete a C5H5N, amely a heterociklusos alaprendszerekhez hozzárendelhető, és egy legegyszerűbb azint képez hattagú gyűrű formájában, egy nitrogénatommal és öt szénatommal.
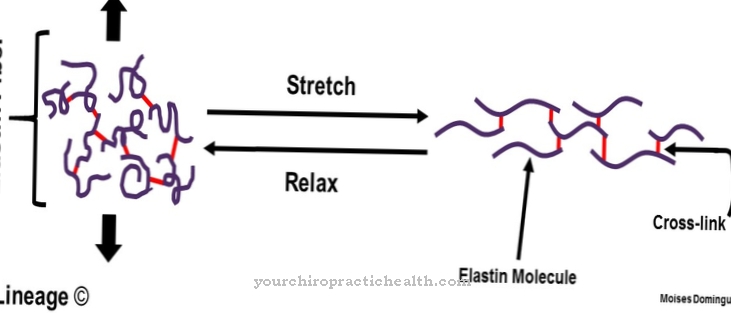
Központi piridiniumgyűrűjének köszönhetően a dezmosin képes egyesíteni az egyes proteinszálakat az elasztin rostfehérjében. Az elasztin összetétele hasonló a kollagénéé. A hidroxilizin helyett azonban az elasztinnal jelentős a valin aránya. A lizinmaradványokat a lizil-oxidáz enzim alizinné oxidálja. Három alizin és egy lizin viszont gyűrű alakjában desmosint képeznek. Ez a forma jelentős szerepet játszik egy teljes elasztin molekula rugalmasságában.
Fehérjehálózatként az elasztin dezmosinnal kötött egységekből áll, és rugalmasan nyújtható. A tüdő, valamint a bőr és az erek függnek az elasztintól és annak dezmosintól, mivel csak így kapják meg jelentős rugalmasságukat. A dezmoszin kék fényben fluoreszkál ultraibolya fényben, és sárga színét, oldhatatlanságát vízben, hőstabilitást, lúgokkal és proteázokkal szembeni ellenálló képességét adja meg.
Oktatás, előfordulás, tulajdonságok és optimális értékek
A dezmoszin képződését dezmoszin bioszintézisnek is nevezik. Ezen bioszintézis során az L-lizin egységek terminális aminocsoportjait a lizil-oxidáz enzim oxidáció útján ω-aldehidekké alakítja.
A lizil-oxidáz egy fehérje lizin-6-oxidáz, és enzimnek felel meg, amely a kötőszövet extracelluláris térében fordul elő. Az elasztin és a kollagén térhálósításában katalizátorként és mechanikai stabilizátorként szolgál a fehérjék számára. A dezmosin bioszintézise során a lizil-oxidáz a lizint alizinné alakítja. Ez a folyamat az extracelluláris mátrixban zajlik és stabilizálja a kollagén és az elasztin közötti keresztkötéseket.Kémiai szempontból a reakció megfelel az oxidatív deaminációnak az aldehid képzéséhez. Az allizin alizinaldolt vagy deszmosint aldolkondenzáción keresztül képezi a szomszédos tropelasztin molekulák aldehid maradékaival.
A megmaradó lizin az aminocsoportján keresztül Schiff-bázist képez, és izo-dezmozint hoz létre. Az erek, a tüdő és a bőr mellett az összes mikrofibrill különösen deszmosint hordoz. Ezek a kollagén, retikuláris és elasztikus szövetek legkisebb rostjai.
Betegségek és rendellenességek
Különböző betegségek esetén megszakad az elasztin képződése olyan komponensekből, mint a dezmosin. Ezek a betegségek elsősorban az ELN gén mutációit tartalmazzák. Ezek közül a legfontosabb a dermatochalasis, a Williams-Beuren szindróma és a subvalvularis veleszületett aorta stenosis. A dermatochalasis a kötőszövet változásainak csoportja, amely családi felhalmozódással jár.
Erre a csoportra jellemző a test különböző részein a megereszkedett, kevésbé elasztikus és ráncos bőr. Az ELN gén az elasztint kódolja, és mutációval okozhatja ezeket a tüneteket. Ezzel összehasonlítva a Williams-Beuren-szindróma meglehetősen ritka, 20 000 újszülött közül csak egyet érint. A betegséget a hetedik kromoszóma hibája okozza. A gén lókusz 7q11,23. Ezen a ponton fellépő hiba miatt az érintett személynek hiányzik az elasztin gén és a szomszédos gének. Az elasztin gén deléciója arcdiszmorfizmust és rendellenességeket okoz a belső szerv struktúrájában. Szívkárosodások, például szupravalvuláris aorta stenosis és vese rendellenességek, például patkó vese vagy vese vaszkuláris stenosis következhetnek be. Ezen felül gyakran van kognitív fogyatékosság.
Az érintettek mentális képességei átlag alatt vannak. A verbális kifejezőképesség ellenére többnyire kevés tartalommal rendelkező mondatokat alkotnak. Rendkívül korai korban kezdik el olvasni, ami gyakran túlbecsüli szellemi képességeiket. A hiperlexia mellett a tökéletes hangmagasságuk gyakran túlértékelésekhez vezet. Az elasztin mutáció egyik formájaként a szubvalvuláris veleszületett aorta stenosis a szívdaganatok rendellenességének felel meg, amely a fő artéria szűkülésével jár. A szupravalvuláris stenosis az aorta szelepén fekszik az aorta elején.
A szívhibának ezt a formáját gyakran homokóra alakú szűkítések jellemzik, amelyek a koszorúér kimenete felett vannak. Az aorta emelkedő része szintén szűkíthető. Az aorta stenosis ezen formája különösen gyakran fordul elő az imént tárgyalt Williams-Beuren-szindróma összefüggésében. Ezt a szívhibát a betegségtől függetlenül már megfigyelték. Ebben az esetben azonban nem feltétlenül kapcsolódik az elasztin gén mutációjához.

.jpg)
.jpg)


.jpg)




.jpg)