Lizil-hidroxilázok olyan enzimek egy csoportját képviselik, amelyek felelősek a fehérjékben lévő lizinmaradékok hidroxilálásáért. Tehát elsősorban a kötőszövet szerkezetéhez járulnak hozzá. A lizil-hidroxilázok működési rendellenességei olyan betegségekben nyilvánulnak meg, mint a skorbut vagy az örökletes Ehlers-Danlos szindróma.
Melyek a lizil-hidroxilázok?
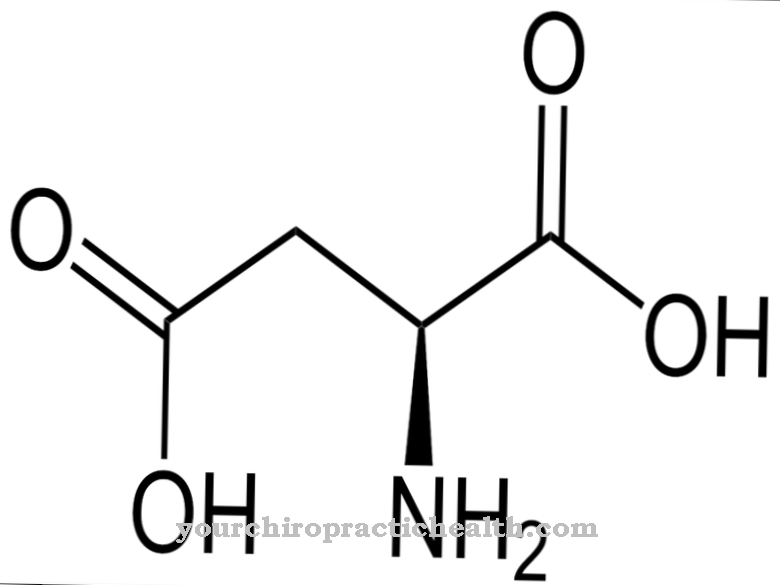
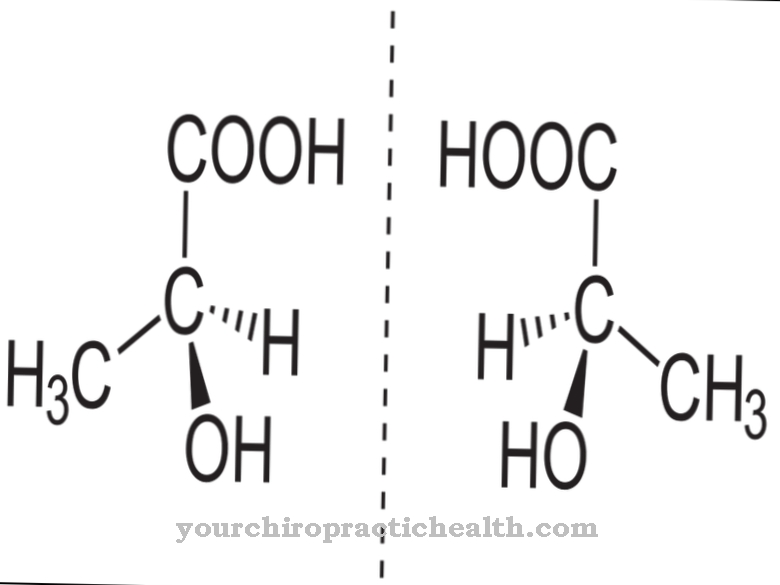
A lizil-hidroxilázok olyan enzimek, amelyek feladata a lizin aminosav poszt-transzlációs módosításának katalizálása egy hidroxilcsoportnak a hidroxil-lizinnel történő beépítésével. Ez erősíti a kötőszövetet, mivel protein láncai lehetőséget kapnak a továbbképződésre a hidroxilcsoportokon keresztül.
A humán lizil-hidroxiláz 727 aminosavból áll. A lizil-hidroxilázok a hidroxilázok csoportjába is tartoznak, azaz olyan enzimek, amelyek általában a hidroxilcsoportok molekulákba való beépülését katalizálják. A lizil-hidroxilázokon kívül a hidroxilázok vagy oxidoreduktázok magukba foglalják a prolil-hidroxilázokat, fenilalanin-hidroxilázt, tirozin-hidroxilázt vagy triptofán-hidroxilázt is. Különösen a prolil-hidroxilázokkal együtt a lizil-hidroxilázok fontos szerepet játszanak a kötőszövet működésében. Mindkét enzimcsoport működéséhez szükséges a C-vitamin koenzim.
Funkció, hatás és feladatok
A lizil-hidroxilázok funkciója kizárólag a hidroxilcsoportok lizinmaradékokba való beépítésének katalizálásából áll egy proteinben. A transzláció utáni módosítás során a hidroxil-amin aminosav lizinből képződik.
Noha a hidroxil-amin szintén szabad, ebben a formában nem integrálható fehérjébe. A poszt-transzlációs módosítás tehát ezen aminosav konverzióját jelenti a protein felépítése után. Ha hidrogénatomot cserélnek a hidroxilcsoportra, akkor egy funkcionális csoport, amely áthidaló funkciókat tud végrehajtani, ezen a ponton épül be a fehérjébe. A hidroxilcsoport segítségével különböző protein láncok kapcsolódhatnak egymáshoz. Ezenkívül a cukormolekulák kötődhetnek ehhez a funkcionális csoporthoz. Mindkét reakció nagyon fontos, többek között, a kötőszövet fejlődésében.
A kötőszövet körülzárja a szervezetet és a belső szerveket. Erősnek és feszesnek kell lennie ahhoz, hogy megkülönböztesse a funkcionálisan különböző szerveket. Ezt a kötőszöveti fehérjék biztosítják, amelyek nagy százalékban tartalmazzák a lizint és a prolint.Ebből a célból a fehérjébe történő beépítésüket követően hidroxilcsoport hozzáadásával mindkét aminosavat részlegesen módosítják. Mint már említettük, prolinnal ezt a reakciót prolil-hidroxilázok, lizinnel lizil-hidroxilázok katalizálják. A fehérjeképződés után ezek a módosító reakciók olyan fehérjeláncok hálózatát hozzák létre, amelyek szoros kötőszövetet képviselnek.
Mindkét enzim funkciója nélkül egyáltalán nem lenne lehetséges a funkcionális kötőszövet kialakulása. Mindkét enzim azonban csak az aszkorbinsav koenzim, azaz a C-vitamin segítségével működik. A mutáció vagy a C-vitamin hiánya révén szerkezetileg megváltozott enzimek ez a kötőszövet szerkezetének megszakadásához vezethet, és ezáltal súlyos betegségekhez.
Oktatás, előfordulás, tulajdonságok és optimális értékek
A PLOD1 gén felelős a humán lizil-hidroxiláz kódolásáért. A PLOD1 név a lizil-hidroxiláz "Prokollagen-Lysin, 2-Oxoglutarat-5-Dioxygenase 1" nevéből származik. Ez a gén az 1. kromoszómán található. Mivel folyamatosan új kötőszövetet termelnek, állandó igény mutatkozik a lizil-hidroxilázok előállítására. Ennek a génnek a mutációja ezért nagyon súlyos következményekkel járhat a szervezet egészségére.
Betegségek és rendellenességek
A lizil-hidroxilázok működésének zavara különösen fontos szerepet játszik a skorbut és az Ehlers-Danlos szindróma esetében. A skorbut ősi tengerészeti betegségként ismerték, amelyet a C-vitamin hiánya okoz. A C-vitamin, más néven aszkorbinsav, a lizil-hidroxilázok és a prolil-hidroxilázok koenzimjeként funkcionál. Ha hiányzik, akkor a kötőszöveti fehérjében lévő lizin és prolin aminosavak már nem hidroxilálhatók.
Mivel a kötőszöveti fehérjék állandóan felhalmozódnak és bomlanak, a fehérjeláncok egyre kevésbé képesek hálózatba kapcsolni a vitaminhiány időszakában. A kötőszövet meglazul, és már nem képes megfelelően ellátni a funkcióját. A tünetek széles köre fordul elő, beleértve az általános kimerülést, a fertőzésre való hajlamot, az ínyvérzést, a fogak elvesztését, a sebek rossz gyógyulását, súlyos bőrproblémákat, izom pazarlást és sok egyéb egészségkárosodást. A skorbut végül halálhoz vezethet általános szívelégtelenség vagy súlyos fertőzések miatt. Az ősi tengerészek különösen érintettek voltak, mert nem tudtak elegendő C-vitamint kapni a hosszú tengeri utak során.
Kimutatták, hogy a betegség azonnal gyógyul, ha bizonyos ételeket, például káposztát kapnak. Csak később felismerték, hogy a betegség oka a C-vitamin hiány. A tengerészek betegségének skorbut kitörését később megakadályozták a tengerészek káposztával táplálása. Egy másik betegség, amely csak részben tulajdonítható az emberi lizil-hidroxiláz hibájának, az Ehlers-Danlos szindróma. Az Ehlers-Danlos-szindróma kollektív kifejezés különböző örökletes kötőszöveti betegségekre, amelyek különböző okokból származnak. Ezt a szindrómát súlyos kötőszöveti gyengeség jellemzi.
A bőr túlfeszíthető, az ízületek túlmozgathatók. A géntechnológiával módosított lizil-hidroxiláz kiváltja a VI-es típusú Ehlers-Danlos szindrómát. A PLOD1 nevű mutált gén, amely az 1. kromoszómán található, felelős ezért. Az ebből képződött hibás enzim már nem működik teljesen, és csak a lizin hidroxilációs reakcióit képes elegendő mértékben katalizálni. Gyenge kötőszövet alakul ki az ismert tünetekkel, valamint a szem és a belső szervek további bevonásával. A VI típusú Ehlers-Danlos szindróma autoszomális recesszív vonásként örökölhető.





.jpg)
.jpg)

.jpg)